オートファジーにおける選択性
オートファジー(自食)では,二重膜構造のオートファゴソームに,周囲の細胞質が取り込まれて分解される。飢餓応答として一般社会でも知られるほど有名になった。近くのものを飲み込むというメカニズムから非選択的分解のイメージが強いが,病原体や傷ついた細胞内小器官は高選択的に分解される1)。
狙った対象をオートファゴソームで取り囲むためには,からくりが必要である。まず,分解対象とオートファゴソームにそれぞれ親和性をもつ「両面テープのような」タンパク質が介在する。これらはオートファジー受容体とよばれ,p62 タンパク質を代表例として活発に研究されている。
一方,オートファジー受容体による認識には,しばしば分解対象のユビキチン化修飾が前提となる。そこで,「なぜ特定の対象にユビキチン化が起きるか?」が大きな問題となる。手前味噌だが細菌感染系での最近の研究成果を紹介する。
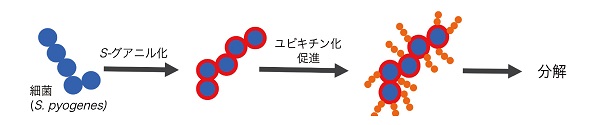
細菌感染細胞では,自然免疫によって一酸化窒素(NO)や活性酸素が発生する。その際,ニトロ化が起きて細胞質では8 -ニトロcGMP2)が生じる。今回,このcGMP 誘導体が細菌排除に関与することがわかった3)。8 -ニトロcGMPは,まず細菌表層に結合(S -グアニル化)する。S -グアニル化された細菌は,続いて選択的なユビキチン化を受け,最終的にオートファジーで分解された。すなわち,8 -ニトロcGMP はオートファジーの選択性を支配する初期の「目印」である3)。
オートファジーは,恒常性維持に加えて,癌,神経変性疾患や感染症など広汎な疾患の抑制にも関わっている。したがって,疾患原因物質の選択的オートファジーは,新たな創薬標的としても有望である。8 -ニトロcGMP の内因性レベルの制御もしくは外部からの投与によって,人工的にオートファジーを促進することも可能である。疾患抑制への応用が期待される。
1) A. Stoltz, A. Ernst, I. Dikic, Nat. Cell Biol. 2014, 16, 495.
2) T. Sawa et al., Nat. Chem. Biol. 2007, 3, 727.
3) C. Ito et al., Mol. Cell 2013, 52, 794.
有本博一 東北大学大学院生命科学研究科