ヘモグロビンとPEGが結合した巨大な環状モノマーの開環重合
Ring-opening Polymerization of Huge Cyclic Monomers of PEGylated Hemoglobin
赤血球に含まれるヘモグロビン(Hb)は酸素を可逆的に結合する分子量6.5万のヘムタンパク質であり,サブユニット間に働く非共有結合性の相互作用により安定なα2β2四量体構造を形成している。Hbは水溶液中でα2β2⇌2αβのように結合と解離の平衡状態にあり,生理的条件下においてαβサブユニットの交換反応が進行する1)。
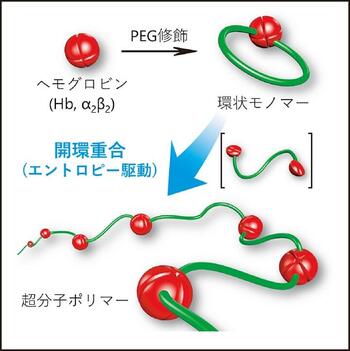
筆者らはCys-93(β)の側鎖SH基を,両端にマレイミド基を持つ分子量0.2~2万のポリエチレングリコール(PEG)とそれぞれ結合させ,分子量が6.7~8.5万,分子の直径が約10~12 nmの巨大な環状モノマーを合成した2, 3)。環状モノマーはα2β2構造の解離に伴い開環し,続いてモノマー同士がαβサブユニット間の相互作用により会合することで,HbとPEGが一次元方向に配列した超分子ポリマーが構築された2, 3)。
この開環重合の熱力学的解析を行ったところ,重合反応はエントロピー駆動型のメカニズムで進行しており,モノマーの環サイズが大きいほど重合しやすくなることが明らかになった3)。また,超分子ポリマーを化学架橋により固定すると,平均分子量が約100万のHb-PEG交互共重合体が得られた2)。
さらに最近,本手法を発展させてHbとPEGを三次元に規則正しく配列することにも成功しており,これら一連のHbポリマーは人工酸素運搬体など,新しい材料としての利用が期待される。
1) T. Matsuhira et al., Biomacromolecules 2018, 19, 3142.
2) T. Matsuhira et al., Biomacromolecules 2019, 20, 1592.
3) T. Matsuhira, H. Sakai, Biomacromolecules 2021, 22, 1944.
松平 崇・酒井宏水 奈良県立医科大学医学部化学教室