細胞内アシルCoA活性化触媒
Chemical Catalyst Enabling In-Cell Acyl-CoA Activation
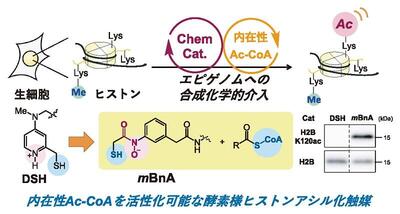
生命はタンパク質などの生体分子と,それらに介在する化学反応のネットワークから成る。その代表が,DNAを細胞核内に収納しているヒストンタンパク質と,その翻訳後修飾が作るエピゲノムである。その多くは酵素(生物触媒)がアセチルCoAなどの細胞代謝物を「試薬」として用いて制御しているが,酵素に代わる「化学」触媒を開発できれば,細胞の持つエピゲノムに介入し,さらにはそれを創出する新手法となる。筆者らは最近,細胞内のアシルCoAを活性化しヒストンをアシル化する化学触媒の開発に成功したので紹介したい1)。
筆者らは,動的チオール・チオエステル交換と求核触媒作用の協働により「試験管内で」アシルCoAを活性化してヒストンをアシル化する触媒DSHを開発している。しかし,「細胞内の」アシルCoAを用いるには活性が十分ではなく,細胞外から高濃度のチオエステル試薬をDSH触媒とともに加える必要があった2)。これはDSHの求核触媒中心である塩基性ピリジンが細胞内ではプロトン化され,求核触媒として不活性化されているからだと考えた。細胞内でむしろ脱プロトン化により活性化されるモチーフ3)を用いれば,より強力な触媒を開発できるはずである。今回開発したヒドロキサム酸触媒mBnA(図)は,外部チオエステル試薬を必要とせず触媒のみで細胞内のヒストンをアシル化可能である。さらに,この特徴を活かし,様々な栄養条件下で変化する核細胞質内アシルCoA濃度と酵素によるヒストンアシル化の関係性の一端を明らかにした。環境に応じて変化する細胞の化学ネットワークに,独立でも直交でもなく,調和する触媒と捉えている。
 1) M. Habazaki et al., Nat. Commun. 2023, 14, 5790.
1) M. Habazaki et al., Nat. Commun. 2023, 14, 5790.
2) Y. Fujiwara et al., PNAS 2021, 118, e2019554118.
3) C. Adamson et al., J. Am. Chem. Soc. 2021, 143, 14976.
山次健三 千葉大学大学院薬学研究院